V oblasti moderní medicíny se antibiotika ukázala jako jeden z nejvýznamnějších pokroků, dramaticky snižující incidenci a úmrtnost spojenou s mikrobiálními infekcemi. Jejich schopnost ovlivnit klinické výsledky bakteriálních infekcí prodloužila průměrnou délku života bezpočtu pacientů. Antibiotika jsou klíčová u složitých lékařských zákroků, včetně chirurgických zákroků, implantací, transplantací a chemoterapie. Výskyt patogenů rezistentních na antibiotika je však stále větším problémem, který v průběhu času snižuje účinnost těchto léků. Případy rezistence na antibiotika byly zdokumentovány u všech kategorií antibiotik, protože dochází k mikrobiálním mutacím. Selekční tlak vyvíjený antimikrobiálními léky přispěl k nárůstu rezistentních kmenů, což představuje významnou výzvu pro globální zdraví.
Pro boj s naléhavým problémem antimikrobiální rezistence je nezbytné zavést účinné politiky kontroly infekcí, které omezí šíření rezistentních patogenů a zároveň sníží používání antibiotik. Kromě toho existuje naléhavá potřeba alternativních léčebných metod. Hyperbarická kyslíková terapie (HBOT) se v této souvislosti ukázala jako slibná metoda, která zahrnuje inhalaci 100% kyslíku při specifických úrovních tlaku po určitou dobu. HBOT, ať už jako primární nebo doplňková léčba infekcí, může nabídnout novou naději v léčbě akutních infekcí způsobených patogeny rezistentními na antibiotika.
Tato terapie se stále častěji používá jako primární nebo alternativní léčba různých onemocnění, včetně zánětů, otravy oxidem uhelnatým, chronických ran, ischemických onemocnění a infekcí. Klinické využití HBOT v léčbě infekcí je rozsáhlé a pacientům poskytuje neocenitelné výhody.

Klinické aplikace hyperbarické oxygenoterapie u infekcí
Současné důkazy silně podporují aplikaci HBOT, a to jak jako samostatné, tak i jako doplňkové léčby, což představuje významný přínos pro infikované pacienty. Během HBOT se tlak kyslíku v arteriální krvi může zvýšit až na 2000 mmHg a výsledný vysoký gradient tlaku kyslíku v tkáních může zvýšit hladinu kyslíku v tkáních až na 500 mmHg. Tyto účinky jsou obzvláště cenné pro podporu hojení zánětlivých reakcí a poruch mikrocirkulace pozorovaných v ischemickém prostředí, jakož i pro zvládání kompartmentového syndromu.
HBOT může také ovlivnit stavy závislé na imunitním systému. Výzkum naznačuje, že HBOT může potlačovat autoimunitní syndromy a antigenem indukované imunitní reakce, čímž pomáhá udržovat toleranci štěpu snížením cirkulace lymfocytů a leukocytů a zároveň modulací imunitních reakcí. HBOT navícpodporuje hojeníu chronických kožních lézí stimulací angiogeneze, což je klíčový proces pro lepší hojení. Tato terapie také podporuje tvorbu kolagenové matrix, což je nezbytná fáze hojení ran.
Zvláštní pozornost je třeba věnovat určitým infekcím, zejména hlubokým a obtížně léčitelným infekcím, jako je nekrotizující fasciitida, osteomyelitida, chronické infekce měkkých tkání a infekční endokarditida. Jedním z nejčastějších klinických aplikací HBOT jsou infekce kůže a měkkých tkání a osteomyelitida spojená s nízkou hladinou kyslíku, které jsou často způsobeny anaerobními nebo rezistentními bakteriemi.
1. Infekce diabetické nohy
Diabetická nohaVředy jsou rozšířenou komplikací u diabetických pacientů a postihují až 25 % této populace. V těchto vředech často vznikají infekce (tvoří 40–80 % případů) a vedou ke zvýšené morbiditě a mortalitě. Infekce diabetické nohy (DFI) obvykle zahrnují polymikrobiální infekce s řadou identifikovaných anaerobních bakteriálních patogenů. Různé faktory, včetně poruch funkce fibroblastů, problémů s tvorbou kolagenu, buněčných imunitních mechanismů a funkce fagocytů, mohou u diabetických pacientů bránit hojení ran. Několik studií identifikovalo zhoršené okysličení kůže jako silný rizikový faktor amputací souvisejících s DFI.
Jako jedna ze současných možností léčby DFIBylo hlášeno, že HBOT významně zlepšuje míru hojení vředů diabetické nohy, a následně snižuje potřebu amputací a komplikovaných chirurgických zákroků. Nejenže minimalizuje nutnost náročných zákroků, jako jsou lalokové operace a kožní štěpy, ale také představuje nižší náklady a minimální vedlejší účinky ve srovnání s chirurgickými možnostmi. Studie Chena a kol. prokázala, že více než 10 sezení HBOT vedlo k 78,3% zlepšení míry hojení ran u diabetických pacientů.
2. Nekrotizující infekce měkkých tkání
Nekrotizující infekce měkkých tkání (NSTI) jsou často polymikrobiální, typicky vznikají kombinací aerobních a anaerobních bakteriálních patogenů a jsou často spojeny s produkcí plynu. I když jsou NSTI relativně vzácné, vykazují vysokou úmrtnost kvůli svému rychlému postupu. Včasná a vhodná diagnóza a léčba jsou klíčem k dosažení příznivých výsledků a HBOT se doporučuje jako doplňková metoda léčby NSTI. Ačkoli ohledně použití HBOT u NSTI přetrvávají spory kvůli nedostatku prospektivních kontrolovaných studií,důkazy naznačují, že by to mohlo souviset se zlepšenou mírou přežití a zachováním orgánů u pacientů s NSTIRetrospektivní studie prokázala významné snížení úmrtnosti u pacientů s NSTI, kteří dostávali HBOT.
1.3 Infekce v místě chirurgického zákroku
Infekce páteře (SSI) lze klasifikovat na základě anatomického místa infekce a mohou vznikat z různých patogenů, včetně aerobních i anaerobních bakterií. Navzdory pokroku v opatřeních pro kontrolu infekcí, jako jsou sterilizační techniky, používání profylaktických antibiotik a zdokonalení chirurgických postupů, SSI zůstávají přetrvávající komplikací.
Jedna významná studie zkoumala účinnost HBOT v prevenci hlubokých SSI po operaci neuromuskulární skoliózy. Předoperační HBOT může významně snížit výskyt SSI a usnadnit hojení ran. Tato neinvazivní terapie vytváří prostředí, kde je v tkáních rány zvýšená hladina kyslíku, což je spojováno s oxidačním ničivým účinkem proti patogenům. Kromě toho řeší sníženou hladinu kyslíku v krvi, která přispívá k rozvoji SSI. Kromě jiných strategií pro kontrolu infekcí se HBOT doporučuje zejména pro chirurgické zákroky s čistou kontaminací, jako jsou kolorektální zákroky.
1.4 Popáleniny
Popáleniny jsou zranění způsobená extrémním teplem, elektrickým proudem, chemikáliemi nebo zářením a mohou představovat vysokou míru morbidity a mortality. HBOT je prospěšná při léčbě popálenin tím, že zvyšuje hladinu kyslíku v poškozených tkáních. Zatímco studie na zvířatech a klinické studie přinášejí smíšené výsledky ohledněÚčinnost HBOT při léčbě popáleninStudie zahrnující 125 pacientů s popáleninami ukázala, že HBOT neprokázala významný vliv na úmrtnost ani na počet provedených operací, ale zkrátila průměrnou dobu hojení (19,7 dne oproti 43,8 dnem). Integrace HBOT s komplexní léčbou popálenin by mohla účinně kontrolovat sepsi u pacientů s popáleninami, což by vedlo ke kratší době hojení a snížené potřebě tekutin. Pro potvrzení role HBOT v léčbě rozsáhlých popálenin je však zapotřebí dalšího rozsáhlého prospektivního výzkumu.
1.5 Osteomyelitida
Osteomyelitida je infekce kosti nebo kostní dřeně, často způsobená bakteriálními patogeny. Léčba osteomyelitidy může být náročná kvůli relativně špatnému prokrvení kostí a omezenému pronikání antibiotik do dřeně. Chronická osteomyelitida je charakterizována přetrvávajícími patogeny, mírným zánětem a nekrotickou tvorbou kostní tkáně. Refrakterní osteomyelitida označuje chronické infekce kostí, které pokračují nebo se opakují i přes vhodnou léčbu.
Bylo prokázáno, že HBOT významně zlepšuje hladinu kyslíku v infikovaných kostních tkáních. Četné kazuistiky a kohortové studie naznačují, že HBOT zlepšuje klinické výsledky u pacientů s osteomyelitidou. Zdá se, že působí prostřednictvím různých mechanismů, včetně zvýšení metabolické aktivity, potlačení bakteriálních patogenů, zesílení antibiotických účinků, minimalizace zánětu a podpory hojení.procesy. Po hyperbarické bronchitidě (HBOT) vykazuje 60 % až 85 % pacientů s chronickou, refrakterní osteomyelitidou známky potlačení infekce.
1.6 Plísňové infekce
Celosvětově trpí chronickými nebo invazivními mykotickými infekcemi více než tři miliony lidí, což každoročně vede k více než 600 000 úmrtím. Výsledky léčby mykotických infekcí jsou často ohroženy faktory, jako je změněný imunitní stav, základní onemocnění a charakteristiky virulence patogenů. Hyperbarická oxygenoterapie (HBOT) se stává atraktivní terapeutickou možností u závažných mykotických infekcí díky své bezpečnosti a neinvazivní povaze. Studie naznačují, že HBOT by mohla být účinná proti mykotickým patogenům, jako je Aspergillus a Mycobacterium tuberculosis.
HBOT podporuje antimykotické účinky inhibicí tvorby biofilmu u Aspergillus, přičemž zvýšená účinnost je zaznamenána u kmenů, kterým chybí geny superoxiddismutázy (SOD). Hypoxické podmínky během plísňových infekcí představují výzvu pro podávání antimykotik, takže zvýšené hladiny kyslíku z HBOT jsou potenciálně prospěšným zásahem, ačkoli je zapotřebí dalšího výzkumu.
Antimikrobiální vlastnosti HBOT
Hyperoxické prostředí vytvořené HBOT iniciuje fyziologické a biochemické změny, které stimulují antibakteriální vlastnosti, což z ní činí účinnou doplňkovou terapii infekcí. HBOT vykazuje pozoruhodné účinky proti aerobním bakteriím a převážně anaerobním bakteriím prostřednictvím mechanismů, jako je přímá baktericidní aktivita, posílení imunitních odpovědí a synergické účinky se specifickými antimikrobiálními látkami.
2.1 Přímé antibakteriální účinky HBOT
Přímý antibakteriální účinek HBOT se z velké části připisuje tvorbě reaktivních forem kyslíku (ROS), mezi které patří superoxidové anionty, peroxid vodíku, hydroxylové radikály a hydroxylové ionty – všechny vznikají během buněčného metabolismu.
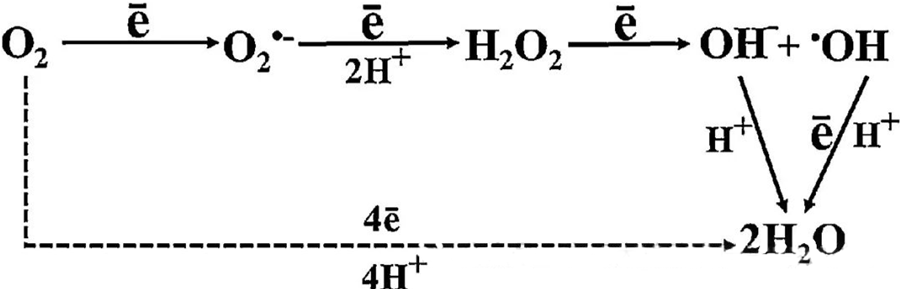
Interakce mezi O₂ a buněčnými složkami je zásadní pro pochopení toho, jak se ROS tvoří v buňkách. Za určitých podmínek označovaných jako oxidační stres je narušena rovnováha mezi tvorbou ROS a jejich degradací, což vede ke zvýšeným hladinám ROS v buňkách. Produkce superoxidu (O₂⁻) je katalyzována superoxiddismutázou, která následně přeměňuje O₂⁻ na peroxid vodíku (H₂O₂). Tato přeměna je dále zesílena Fentonovou reakcí, která oxiduje Fe²⁺ za vzniku hydroxylových radikálů (·OH) a Fe³⁺, čímž se iniciuje škodlivá redoxní sekvence tvorby ROS a poškození buněk.
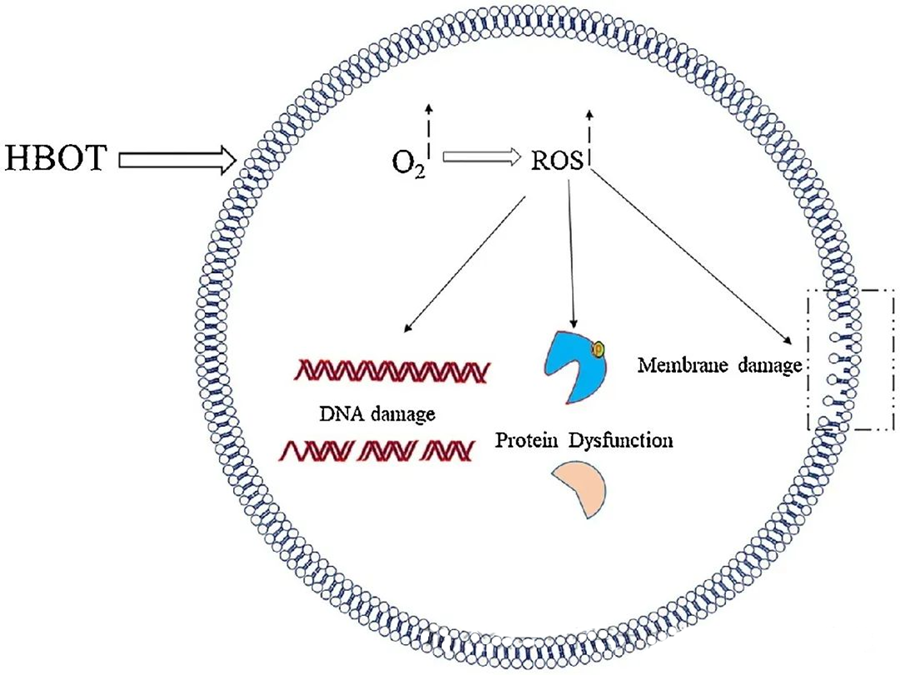
Toxické účinky ROS cílí na kritické buněčné složky, jako je DNA, RNA, proteiny a lipidy. Zejména DNA je primárním cílem cytotoxicity zprostředkované H₂O₂, protože narušuje deoxyribózové struktury a poškozuje základní složení. Fyzikální poškození vyvolané ROS se rozšiřuje na helixovou strukturu DNA, potenciálně v důsledku peroxidace lipidů spuštěné ROS. To podtrhuje nepříznivé důsledky zvýšených hladin ROS v biologických systémech.
Antimikrobiální účinek ROS
ROS hrají zásadní roli v inhibici mikrobiálního růstu, jak je prokázáno na tvorbě ROS indukované HBOT. Toxické účinky ROS přímo cílí na buněčné složky, jako je DNA, proteiny a lipidy. Vysoké koncentrace aktivních forem kyslíku mohou přímo poškozovat lipidy, což vede k peroxidaci lipidů. Tento proces narušuje integritu buněčných membrán a v důsledku toho i funkčnost membránově asociovaných receptorů a proteinů.
Kromě toho proteiny, které jsou také významnými molekulárními cíli ROS, podléhají specifickým oxidačním modifikacím na různých aminokyselinových zbytcích, jako je cystein, methionin, tyrosin, fenylalanin a tryptofan. Například bylo prokázáno, že HBOT indukuje oxidační změny v několika proteinech v E. coli, včetně elongačního faktoru G a DnaK, a tím ovlivňuje jejich buněčné funkce.
Posílení imunity pomocí HBOT
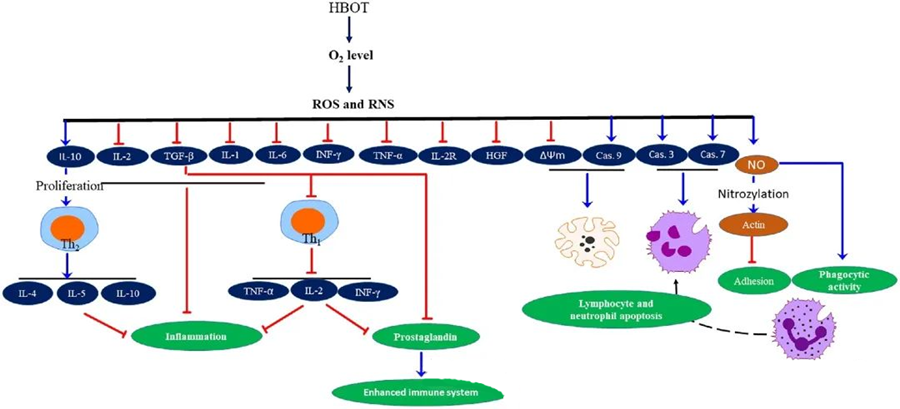
Protizánětlivé vlastnosti HBOTbyly zdokumentovány a ukázaly se jako klíčové pro zmírnění poškození tkání a potlačení progrese infekce. HBOT významně ovlivňuje expresi cytokinů a dalších regulátorů zánětu, čímž ovlivňuje imunitní odpověď. Různé experimentální systémy pozorovaly rozdílné změny v genové expresi a tvorbě proteinů po HBOT, které buď zvyšují, nebo snižují regulaci růstových faktorů a cytokinů.
Během procesu HBOT zvýšené hladiny O₂ spouštějí řadu buněčných reakcí, jako je potlačení uvolňování prozánětlivých mediátorů a podpora apoptózy lymfocytů a neutrofilů. Tyto účinky společně posilují antimikrobiální mechanismy imunitního systému, čímž usnadňují hojení infekcí.
Studie dále naznačují, že zvýšené hladiny O₂ během HBOT mohou snížit expresi prozánětlivých cytokinů, včetně interferonu-gama (IFN-γ), interleukinu-1 (IL-1) a interleukinu-6 (IL-6). Mezi tyto změny patří také snížení poměru CD4:CD8 T buněk a modulace dalších rozpustných receptorů, což v konečném důsledku zvyšuje hladiny interleukinu-10 (IL-10), který je klíčový pro potlačení zánětu a podporu hojení.
Antimikrobiální účinky HBOT jsou propojeny se složitými biologickými mechanismy. Bylo hlášeno, že jak superoxid, tak zvýšený krevní tlak nekonzistentně podporují antibakteriální aktivitu a apoptózu neutrofilů indukovanou HBOT. Po HBOT výrazné zvýšení hladiny kyslíku zvyšuje baktericidní schopnosti neutrofilů, což je základní složka imunitní odpovědi. HBOT dále potlačuje adhezi neutrofilů, která je zprostředkována interakcí β-integrinů na neutrofilech s molekulami mezibuněčné adheze (ICAM) na endotelových buňkách. HBOT inhibuje aktivitu neutrofilního β-2 integrinu (Mac-1, CD11b/CD18) prostřednictvím procesu zprostředkovaného oxidem dusnatým (NO), což přispívá k migraci neutrofilů do místa infekce.
Přesné přeskupení cytoskeletu je nezbytné pro to, aby neutrofily mohly účinně fagocytovat patogeny. Bylo prokázáno, že S-nitrosylace aktinu stimuluje polymeraci aktinu, což potenciálně usnadňuje fagocytární aktivitu neutrofilů po předchozí léčbě HBOT. HBOT navíc podporuje apoptózu v lidských T-buněčných liniích mitochondriálními drahami, přičemž po HBOT byla hlášena zrychlená smrt lymfocytů. Blokování kaspázy-9 – bez ovlivnění kaspázy-8 – prokázalo imunomodulační účinky HBOT.
Synergické účinky HBOT s antimikrobiálními látkami
V klinických aplikacích se HBOT často používá spolu s antibiotiky k účinnému boji proti infekcím. Hyperoxický stav dosažený během HBOT může ovlivnit účinnost některých antibiotik. Výzkum naznačuje, že specifické baktericidní léky, jako jsou β-laktamy, fluorochinolony a aminoglykosidy, působí nejen prostřednictvím inherentních mechanismů, ale také částečně spoléhají na aerobní metabolismus bakterií. Proto je přítomnost kyslíku a metabolické vlastnosti patogenů klíčová při hodnocení terapeutických účinků antibiotik.
Významné důkazy ukazují, že nízké hladiny kyslíku mohou zvýšit rezistenci Pseudomonas aeruginosa vůči piperacilinu/tazobaktamu a že prostředí s nízkým obsahem kyslíku také přispívá ke zvýšené rezistenci Enterobacter cloacae vůči azithromycinu. Naopak určité hypoxické podmínky mohou zvýšit citlivost bakterií na tetracyklinová antibiotika. HBOT slouží jako vhodná doplňková terapeutická metoda indukcí aerobního metabolismu a reoxygenací hypoxicky infikovaných tkání, čímž se následně zvyšuje citlivost patogenů na antibiotika.
V preklinických studiích kombinace HBOT – podávané dvakrát denně po dobu 8 hodin při tlaku 280 kPa – spolu s tobramycinem (20 mg/kg/den) významně snížila bakteriální zátěž u infekční endokarditidy způsobené Staphylococcus aureus. To ukazuje potenciál HBOT jako pomocné léčby. Další výzkumy ukázaly, že při teplotě 37 °C a tlaku 3 ATA po dobu 5 hodin HBOT výrazně zvýšila účinky imipenemu proti Pseudomonas aeruginosa infikované makrofágy. Kromě toho se ukázalo, že kombinovaná modalita HBOT s cefazolinem je účinnější při léčbě osteomyelitidy způsobené Staphylococcus aureus u zvířecích modelů ve srovnání se samotným cefazolinem.
HBOT také významně zvyšuje baktericidní účinek ciprofloxacinu proti biofilmům Pseudomonas aeruginosa, zejména po 90 minutách expozice. Toto zvýšení se připisuje tvorbě endogenních reaktivních forem kyslíku (ROS) a vykazuje zvýšenou citlivost u mutantů s defektem peroxidázy.
V modelech pleuritidy způsobené methicilin-rezistentním Staphylococcus aureus (MRSA) prokázal společný účinek vankomycinu, teikoplaninu a linezolidu s HBOT významně zvýšenou účinnost proti MRSA. Metronidazol, antibiotikum hojně používané k léčbě závažných anaerobních a polymikrobiálních infekcí, jako jsou infekce diabetické nohy (DFI) a infekce v místě chirurgického zákroku (SSI), vykazoval vyšší antimikrobiální účinnost za anaerobních podmínek. Je opodstatněné provést další studie, které by prozkoumaly synergické antibakteriální účinky HBOT v kombinaci s metronidazolem v podmínkách in vivo i in vitro.
Antimikrobiální účinnost HBOT na rezistentní bakterie
S vývojem a šířením rezistentních kmenů tradiční antibiotika často časem ztrácejí svou účinnost. HBOT se navíc může ukázat jako nezbytná při léčbě a prevenci infekcí způsobených patogeny rezistentními na více léčiv a může sloužit jako kritická strategie v případě selhání antibiotické léčby. Četné studie uvádějí významné baktericidní účinky HBOT na klinicky relevantní rezistentní bakterie. Například 90minutová HBOT terapie při tlaku 2 ATM podstatně snížila růst MRSA. V poměrových modelech navíc HBOT zvýšila antibakteriální účinky různých antibiotik proti infekcím MRSA. Zprávy potvrdily, že HBOT je účinná při léčbě osteomyelitidy způsobené bakterií Klebsiella pneumoniae produkující OXA-48, aniž by bylo nutné podávat jakákoli podpůrná antibiotika.
Stručně řečeno, hyperbarická kyslíková terapie představuje mnohostranný přístup ke kontrole infekcí, posiluje imunitní odpověď a zároveň zesiluje účinnost stávajících antimikrobiálních látek. Díky komplexnímu výzkumu a vývoji má potenciál zmírnit účinky antibiotické rezistence a nabízí naději v probíhajícím boji proti bakteriálním infekcím.
Čas zveřejnění: 28. února 2025

