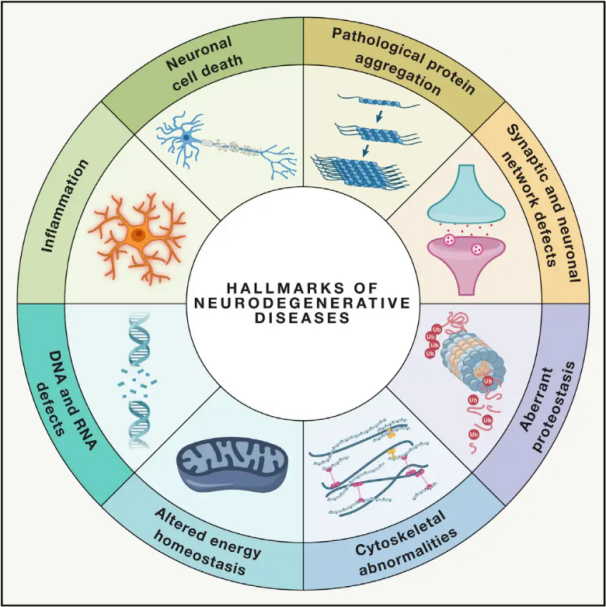
Neurodegenerativní onemocnění(NDD) jsou charakterizovány progresivní nebo přetrvávající ztrátou specifických zranitelných neuronálních populací v mozku nebo míše. Klasifikace NDD může být založena na různých kritériích, včetně anatomického rozložení neurodegenerace (jako jsou extrapyramidové poruchy, frontotemporální degenerace nebo spinocerebelární ataxie), primárních molekulárních abnormalit (jako je amyloid-β, priony, tau nebo α-synuklein) nebo hlavních klinických příznaků (jako je Parkinsonova choroba, amyotrofická laterální skleróza a demence). Navzdory těmto rozdílům v klasifikaci a prezentaci symptomů sdílejí poruchy, jako je Parkinsonova choroba (PD), amyotrofická laterální skleróza (ALS) a Alzheimerova choroba (AD), společné základní procesy vedoucí k neuronální dysfunkci a nakonec k buněčné smrti.
Světová zdravotnická organizace odhaduje, že vzhledem k tomu, že neurodegenerativními onemocněními (NDD) jsou po celém světě postiženy miliony lidí, se tato onemocnění do roku 2040 stanou druhou nejčastější příčinou úmrtí v rozvinutých zemích. Přestože existují různé léčebné metody ke zmírnění a léčbě symptomů spojených se specifickými onemocněními, účinné metody ke zpomalení nebo vyléčení progrese těchto onemocnění zůstávají nedosažitelné. Nedávné studie naznačují posun v léčebných paradigmatech od pouhé symptomatické léčby k využití mechanismů ochrany buněk k prevenci dalšího zhoršování. Rozsáhlé důkazy naznačují, že oxidační stres a zánět hrají klíčovou roli v neurodegeneraci, což tyto mechanismy staví do popředí jako kritické cíle pro buněčnou ochranu. V posledních letech základní a klinický výzkum odhalil potenciál hyperbarické kyslíkové terapie (HBOT) v léčbě neurodegenerativních onemocnění.
Pochopení hyperbarické kyslíkové terapie (HBOT)
Hyperbarická oxygenoterapie (HBOT) obvykle zahrnuje zvýšení tlaku nad 1 absolutní atmosféru (ATA) – tlak na hladině moře – po dobu 90–120 minut, což často vyžaduje několik sezení v závislosti na konkrétním léčeném onemocnění. Zvýšený tlak vzduchu zlepšuje přísun kyslíku do buněk, což následně stimuluje proliferaci kmenových buněk a posiluje hojivé procesy zprostředkované určitými růstovými faktory.
Původně bylo použití HBOT založeno na Boyleově-Marriottově zákonu, který předpokládá tlakově závislé snížení množství plynových bublin a zároveň výhody vysoké hladiny kyslíku v tkáních. Existuje řada patologií, u kterých je známo, že hyperoxický stav vyvolaný HBOT prospívá, včetně nekrotických tkání, radiačních poranění, traumatu, popálenin, kompartmentového syndromu a plynové gangrény, mimo jiné uvedených Podmořskou a hyperbarickou lékařskou společností. HBOT prokázala také účinnost jako doplňková léčba u různých modelů zánětlivých nebo infekčních onemocnění, jako je kolitida a sepse. Vzhledem ke svým protizánětlivým a oxidačním mechanismům nabízí HBOT významný potenciál jako terapeutická cesta k neurodegenerativním onemocněním.
Preklinické studie hyperbarické oxygenoterapie u neurodegenerativních onemocnění: Poznatky z myšího modelu 3×Tg
Jedna z pozoruhodných studiízaměřila se na myší model Alzheimerovy choroby (AD) s 3×Tg, který demonstroval terapeutický potenciál HBOT při zmírňování kognitivních deficitů. Výzkum zahrnoval 17měsíční samce myší 3×Tg ve srovnání se 14měsíčními samci myší C57BL/6, kteří sloužili jako kontrola. Studie prokázala, že HBOT nejen zlepšila kognitivní funkce, ale také významně snížila zánět, plak a fosforylaci tau proteinu – kritický proces spojený s patologií AD.
Ochranné účinky HBOT byly přičítány snížení neurozánětlivých procesů. To se projevilo snížením proliferace mikroglií, astrogliózy a sekrece prozánětlivých cytokinů. Tato zjištění zdůrazňují dvojí roli HBOT ve zlepšení kognitivních funkcí a současném zmírnění neurozánětlivých procesů spojených s Alzheimerovou chorobou.
Jiný preklinický model využil myši s 1-methyl-4-fenyl-1,2,3,6-tetrahydropyridin (MPTP) k vyhodnocení ochranných mechanismů HBOT na neuronální funkci a motorické schopnosti. Výsledky ukázaly, že HBOT přispívá ke zvýšení motorické aktivity a síly úchopu u těchto myší, což koreluje se zvýšením signalizace mitochondriální biogeneze, konkrétně prostřednictvím aktivace SIRT-1, PGC-1α a TFAM. To zdůrazňuje významnou roli mitochondriální funkce v neuroprotektivních účincích HBOT.
Mechanismy HBOT u neurodegenerativních onemocnění
Základní princip využití HBOT pro neurodegenerativní onemocnění (NDD) spočívá ve vztahu mezi sníženým přísunem kyslíku a náchylností k neurodegenerativním změnám. Hypoxií indukovatelný faktor 1 (HIF-1) hraje ústřední roli jako transkripční faktor, který umožňuje buněčnou adaptaci na nízký tlak kyslíku, a je spojován s různými NDD, včetně Alzheimerovy choroby, Parkinsonovy choroby, Huntingtonovy choroby a ALS, což jej označuje za klíčový cíl pro léky.
Vzhledem k tomu, že věk je významným rizikovým faktorem pro vznik mnoha neurodegenerativních poruch, je zkoumání vlivu HBOT na neurobiologii stárnutí zásadní. Studie ukázaly, že HBOT může zlepšit kognitivní deficity související s věkem u zdravých starších jedinců.Starší pacienti s významným poškozením paměti navíc po expozici HBOT vykazovali kognitivní zlepšení a zvýšený průtok krve mozkem.
1. Vliv HBOT na zánět a oxidační stres
HBOT prokázala schopnost zmírnit neurozáněty u pacientů s těžkou mozkovou dysfunkcí. Má schopnost snižovat prozánětlivé cytokiny (jako je IL-1β, IL-12, TNFα a IFNγ) a zároveň zvyšovat protizánětlivé cytokiny (jako je IL-10). Někteří vědci se domnívají, že reaktivní formy kyslíku (ROS) generované HBOT zprostředkovávají několik prospěšných účinků terapie. V důsledku toho, kromě tlakově závislého účinku na redukci bublin a dosažení vysoké saturace tkání kyslíkem, jsou pozitivní výsledky spojené s HBOT částečně závislé na fyziologických rolích produkovaných ROS.
2. Účinky HBOT na apoptózu a neuroprotekci
Výzkum ukázal, že HBOT může snížit fosforylaci mitogenem aktivované proteinkinázy p38 (MAPK) v hipokampu, a následně zlepšit kognitivní funkce a zmírnit poškození hipokampu. Bylo zjištěno, že jak samostatná HBOT, tak v kombinaci s extraktem z ginkgo biloby snižují expresi Bax a aktivitu kaspázy-9/3, což vede ke snížení míry apoptózy indukované aβ25-35 u hlodavců. Jiná studie dále prokázala, že prekondicionace HBOT indukuje toleranci vůči mozkové ischemii s mechanismy zahrnujícími zvýšenou expresi SIRT1, spolu se zvýšenými hladinami B-buněčného lymfomu 2 (Bcl-2) a sníženou aktivní kaspázou-3, což podtrhuje neuroprotektivní a antiapoptotické vlastnosti HBOT.
3. Vliv HBOT na krevní oběh aNeurogeneze
Vystavení subjektů HBOT bylo spojováno s řadou účinků na lebeční cévní systém, včetně zvýšení propustnosti hematoencefalické bariéry, podpory angiogeneze a snížení otoků. Kromě zajištění zvýšeného přísunu kyslíku do tkání HBOTpodporuje tvorbu cévaktivací transkripčních faktorů, jako je vaskulární endoteliální růstový faktor, a stimulací proliferace nervových kmenových buněk.
4. Epigenetické účinky HBOT
Studie ukázaly, že vystavení lidských mikrovaskulárních endoteliálních buněk (HMEC-1) hyperbarickému kyslíku významně reguluje 8 101 genů, včetně upregulované i downregulované exprese, což zdůrazňuje zvýšení genové exprese spojené s dráhami antioxidační odpovědi.
Závěr
Používání HBOT v průběhu času dosáhlo významného pokroku, což prokázalo její dostupnost, spolehlivost a bezpečnost v klinické praxi. Přestože HBOT byla zkoumána jako off-label léčba NDD a byl proveden určitý výzkum, stále existuje naléhavá potřeba důkladných studií ke standardizaci postupů HBOT při léčbě těchto stavů. Další výzkum je nezbytný pro stanovení optimální frekvence léčby a posouzení rozsahu prospěšných účinků pro pacienty.
Stručně řečeno, průnik hyperbarického kyslíku a neurodegenerativních onemocnění ukazuje slibnou hranici terapeutických možností, která si zaslouží další výzkum a validaci v klinickém prostředí.
Čas zveřejnění: 16. května 2025

